Modelowanie układu krążenia z możliwością równoległego wspomagania pracy komór serca w pakiecie programowym PExSim
Alicja Golnik, Bartłomiej Fajdek, Krzysztof Janiszowski print
Artykuł zawiera opis modelu układu krążenia wykonany w pakiecie programowym PExSim i wyniki przeprowadzonych symulacji numerycznych pracy układu krążenia dla stanów: fizjologicznego prawidłowego, patologicznego oraz przy wspomaganiu lewokomorowym.
W ostatnich latach powstało wiele różnych modeli numerycznych układu sercowo-naczyniowego człowieka. Mogą być używane do odtwarzania warunków fizjologicznych prawidłowych, jak i stanów patologicznych. Pozwala to na ich wykorzystanie w celach: badawczych, rozwoju urządzeń medycznych oraz edukacyjnych. W wielu przypadkach są opracowywane pod kątem konkretnego problemu naukowego, jak np. modelowania krążenia pozaustrojowego [1], krążenia płucnego [2] czy zastosowania w terapii rozszerzenia naczyń krwionośnych [3]. Powstają również ogólne modele matematyczne układu krążenia człowieka, pozwalające na jego przystosowanie do wielu różnych zastosowań.
Głównym celem opisanej pracy jest wykonanie numerycznej platformy badawczej umożliwiającej testowanie algorytmów sterowania urządzenia wspomagającego pracę serca. W tym celu opracowany został model numeryczny układu krążenia oraz urządzenia wspomagającego przy wykorzystaniu pakietu programowego PExSim (Process Explorer and Simulator). Oprogramowanie to jest elastycznym narzędziem umożliwiającym modelowanie rozbudowanych układów dynamicznych. W jego skład wchodzi zestaw predefiniowanych bloków funkcyjnych, zarówno statycznych jak i dynamicznych oraz różnorodne bloki umożliwiające modelowanie podstawowych zależności matematycznych, logicznych czy obsługujących operacje wejścia/wyjścia. Otwarta architektura pozwala na implementację dodatkowych elementów. W ten sposób dodano do programu zestaw bloków funkcyjnych, które odwzorowują pracę urządzenia wspomagającego oraz poszczególnych podsystemów układu krążenia. Elementy modelu zgrupowane zostały w bibliotece HCS (Human Circulatory System). Opisany sposób implementacji umożliwia przedstawienie układu krążenia człowieka w postaci odpowiedniego połączenia poszczególnych elementów. Dostosowanie modelu do konkretnego przypadku klinicznego odbywa się przez modyfikację parametrów poszczególnych bloków. Dzięki temu, możliwa jest symulacja stanów fizjologicznych prawidłowych i patologicznych, jak również odtwarzanie przebiegów niektórych wielkości hemodynamicznych niedostępnych lub trudno dostępnych pomiarowo.
Opis biblioteki układu krążenia człowieka (HCS)
Wykonana biblioteka układu krążenia składa się z bloków funkcyjnych modelujących pracę poszczególnych elementów układu krążenia.
W skład biblioteki wchodzą:
- lewa komora serca (LH)
- prawa komora serca (RH)
- układ tętniczy krążenia systemowego (SAC)
- układ żylny krążenia systemowego (SVC)
- układ tętniczy krążenia płucnego (PAC)
- układ żylny krążenia płucnego (PVC)
- urządzenie wspomagające pracę serca (VAD).
Odtwarzanie warunków panujących w poszczególnych elementach układu krążenia oparte jest na opisie matematycznym zawartym w [4]. Odpowiednie połączenie bloków w układ zamknięty tworzy pełny model układu krążenia (rys. 2).
Lewa i prawa komora serca
Serce składa się z dwóch komór, przy czym lewa komora odpowiedzialna jest za pompowanie krwi poprzez aortę do całego organizmu a prawa za zapewnienie przepływu w płucnym układzie krążenia. W fazie rozkurczu następuje zasilenie komory krwią z przedsionka natomiast skurcz komory powoduje wyrzut krwi do tętnicy głównej i dalszy jej przepływ w naczyniach krwionośnych. W przedstawionym przypadku pracę lewej komory serca reprezentuje blok LH (Left Heart), a prawej blok RH (Right Heart). Opis, matematyczny funkcjonowania obu komór jest taki sam, rożni się natomiast znacząco parametrami, takimi jak: opory przepływów oraz wartość elastancji końcowo-skurczowej.
Model matematyczny komory opiera się na prawie Starlinga [5], mówiącym o równowadze między charakterystykami napełniania i opróżniania komory. Na podstawie informacji o ciśnieniu przedsionkowym oraz ciśnieniu w tętnicy głównej wyznaczana jest wartość natężenia przepływu krwi zasilającej oraz opuszczającej komorę. Dodatkowo wyznaczana jest wartość ciśnienia komorowego i objętość chwilowa komory (rys. 3).
Podstawową zależnością opisu matematycznego jest funkcja umożliwiająca oszacowanie wartości ciśnienia w komorze serca [6, 4]:
| (1) |
gdzie: Pν(t) − ciśnienie w komorze serca, Vν(t) − objętość komory, V0 − objętość szczątkowa komory (przy zerowym ciśnieniu), Eν(t) – funkcja elastancji znormalizowana do wartości jeden, Emax – wartość maksymalna funkcji elastancji (końcowo-skurczowa), f(…) − funkcja korekcyjna zależna od wartości objętości komory i tempa wyrzutu; A, B, C, j, k – stałe parametry, modyfikujące kształt i pozycję charakterystyki napełniania.
Wartości natężeń przepływów obliczane są natomiast jako iloraz wartości spadku ciśnienia i oporów przepływu. Na przykład, dla lewej komory:
| (2) | |
| (3) |
gdzie: Qli(t) – natężenie przepływu zasilającego lewą komorę, Qlo(t) – natężenie przepływu wyjściowego z komory, Pla(t) – ciśnienie w lewym przedsionku, Pas(t) – ciśnienie w układzie tętniczym krążenia systemowego, Rli, Rlo – oporność wejściowa i wyjściowa komory.
Parametrami bloków LH i RH są: wartość maksymalna funkcji elastancji, oporność wejściowa i wyjściowa komory, oporność układu tętnic krążenia systemowego i parametry stałe charakterystyki napełniania. Funkcja elastancji jest kluczowym elementem opisu matematycznego komory. To od jej kształtu i wartości maksymalnej w znacznej mierze zależą wartości przepływów. W opisywanym modelu wykorzystywana jest funkcja elastancji zaproponowana w [6].
Układ tętniczy krążenia systemowego
Układ tętniczy krążenia systemowego modelowany jest poprzez blok funkcyjny SAC (Systemic Arterial Circulation). Wielkościami wejściowymi dla bloku (rys. 4) są: ciśnienie w układzie żylnym krążenia systemowego, natężenie przepływu krwi opuszczającej lewą komorę serca oraz natężenie przepływu wyjściowego z urządzenia wspomagającego LVAD (Left Ventricle Assist Device).
Wewnątrz bloku obliczane są wartości: ciśnienia tętniczego, natężenia przepływu krwi opuszczającej tętnice i zasilającej system żylny oraz ciśnienie panujące za zastawką aortalną zgodnie z zależnościami:
| (4) | |
| (5) | |
| (6) | |
| (7) |
gdzie: Qas(t) – natężenie przepływu w układzie tętnic krążenia systemowego, Ql(t) – natężenie przepływu wejściowego do układu tętniczego, Qxo(t) − natężenie przepływu wyjściowego z urządzenia wspomagającego LVAD, Pvs(t) – ciśnienie w układzie żylnym krążenia systemowego, Pil(t) – ciśnienie krwi w aorcie, Ras – oporność układu tętnic krążenia systemowego, Rcs – wejściowa oporność układu tętnic krążenia systemowego, Cas – podatność układu tętnic krążenia systemowego, Cil – wejściowa podatność układu tętnic krążenia systemowego.
Właściwości bloku można modyfikować i dostosowywać do aktualnych potrzeb poprzez zmiany parametrów, takich jak: opór, opór wejściowy i podatność układu tętnic krążenia systemowego.
Układ tętniczy krążenia płucnego
Krążenie tętnicze płucne odwzorowywane jest przez blok funkcyjny PAC (Pulmonary Arterial Circulation). Wielkościami wejściowymi dla bloku jest ciśnienie panujące w układzie żylnym krążenia płucnego, wartość natężenia przepływu krwi opuszczającej prawą komorę serca i natężenie przepływu wyjściowego z urządzenia wspomagającego RVAD (Right Ventricle Assist Device).
Wewnątrz bloku (rys. 5) obliczane są wartości ciśnienia w tętnicach płucnych, przepływ krwi opuszczającej tętnice i zasilającej system żylny oraz ciśnienie panujące w tętnicy głównej układu zgodnie z zależnościami:
| (8) | |
| (9) | |
| (10) | |
| (11) |
gdzie: Qap(t) – natężenie przepływu krwi w układzie tętnic krążenia płucnego, Qr(t) – natężenie przepływu wejściowego do układu tętniczego, Qro(t) – natężenie przepływu wyjściowego z naturalnej komory serca, Qxo(t) − natężenie przepływu wyjściowego z urządzenia wspomagającego RVAD, Pap(t) – ciśnienie tętnicze w układzie krążenia płucnego, Pvp(t) – ciśnienie żylne w układzie krążenia płucnego, Pir(t) – ciśnienie krwi w głównej tętnicy płucnej, Rap – oporność układu tętnic krążenia płucnego, Rcp – wejściowy opór układu tętnic krążenia płucnego, Cap – podatność układu tętnic krążenia płucnego, Cir – wejściowa podatność układu tętnic krążenia płucnego, Lp – inertancja układu tętnic krążenia płucnego.
Przez zmianę wartości oporu, oporu wejściowego, podatności czy inertancji układu tętnic krążenia płucnego, można modyfikować funkcje bloku i dostosowywać je do aktualnych wymagań.
Układ żylny krążenia systemowego i płucnego
Blok SVC (Systemic Venous Circulation) modeluje układ żylny krążenia systemowego. Wielkościami wejściowymi jest natężenie przepływu krwi opuszczającej tętnice oraz zasilającej prawą komorę serca. W celu umożliwienia symulacji wpływu wspomagania prawokomorowego na układ krążenia, opracowano odpowiednie zależności i dodano wejście sygnałowe informujące o wartości natężenia przepływu zasilającego urządzenie RVAD.
Informacjami wyjściowymi są: ciśnienie żylne układu systemowego, ciśnienie w prawym przedsionku serca oraz natężenie przepływu krwi opuszczającej żyły. Wyznaczane są one na podstawie następujących zależności:
| (12) | |
| (13) | |
| (14) |
gdzie: Qνs(t) – natężenie przepływu w układzie żylnym krążenia systemowego, Qri(t) – natężenie przepływu zasilającego naturalną komorę serca, Qxi(t) − natężenie przepływu wejściowego urządzenia wspomagającego RVAD, Pvs(t) – ciśnienie żylne w układzie krążenia systemowego, Pra(t) – ciśnienie w prawym przedsionku, Rνs – oporność wejściowa układu żylnego krążenia płucnego, Cvs – podatność żylna układu systemowego, Cra – podatność prawego przedsionka.
Parametrami bloku są: opór i podatność układu żylnego krążenia systemowego oraz podatność prawego przedsionka. Analogiczną funkcję do bloku SVC dla krążenia systemowego pełni blok funkcyjny PVC (Pulmonary Venous Circulation) dla krążenia płucnego. Modeluje on pracę układu żył poprzez wyznaczanie wartości ciśnienia w lewym przedsionku serca oraz ciśnienia i natężenia przepływu w układzie żylnym krążenia płucnego.
Zależności opisujące działanie bloku PVC są analogiczne jak dla modelu krążenia żylnego układu systemowego.
Urządzenie wspomagające pracę układu krążenia
W ostatnich latach powstało wiele różnych typów urządzeń wspomagających pracę układu krążenia (VAD). Obecnie kilka z nich jest już dostępnych dla pacjentów [7, 8, 9]. Klinicznie stosowane są głównie dwa typy urządzeń wspomagających: pompy pulsacyjne oraz pompy wirnikowe o przepływie ciągłym. Opracowany model układu krążenia uzupełniony został o prosty model pulsacyjnego urządzenia wspomagającego (rys. 8) wraz z możliwością połączenia równoległego względem wybranej komory serca naturalnego (rys. 11). Blok VAD (Ventricular Assist Device) odwzorowuje zjawiska fizyczne zachodzące w czasie napełniania i wyrzutu ze sztucznej komory urządzenia.
Ponieważ działanie pulsacyjnej pompy wspomagającej jest bardzo przybliżone do pracy naturalnej komory serca, do opisu matematycznego urządzenia wykorzystany został analogiczny zestaw zależności co w przypadku bloków LH i RH. Zmienione zostały natomiast parametry modelu, tak aby dostosować jego działanie do przybliżonego odtwarzania dynamiki urządzenia wspomagającego. Również w tym przypadku bardzo istotnym parametrem bloku jest maksymalna wartość elastancji, będącej głównym parametrem wpływającym na wielkość przepływu wyjściowego, a co za tym idzie – wartość rzutu minutowego. Synchronizacja względem pracy naturalnej komory serca uzyskana została w wyniku odpowiedniej modyfikacji przebiegu funkcji elastancji.
Przykład zastosowania
Poszczególne elementy biblioteki HCS mogą być połączone w kompletny model układu krążenia człowieka (rys. 2). Przy takim połączeniu przeprowadzona została symulacja pracy układu dla stanu fizjologicznego prawidłowego, czyli przy domyślnych wartościach parametrów poszczególnych bloków funkcyjnych.
W wyniku przeprowadzonych obliczeń numerycznych uzyskać można informacje na temat charakteru zmian wielu istotnych wielkości dotyczących pracy serca i układu krążenia. Przykładowo, analiza pętli pracy serca (na płaszczyźnie ciśnienie-objętość) umożliwia uzyskanie informacji na temat wartości rzutu jednostkowego SV (Stroke Volume) i bilansu energetycznego dla komory serca. Przykładową pętlę pracy lewej komory serca, otrzymaną w wyniku symulacji z zaznaczeniem wartości rzutu jednostkowego (SV), objętości spoczynkowej komory (V0) oraz charakterystyk opróżniania (ESPVR) i napełniania (EDPVR), przedstawiono na rys. 9.
Głównym parametrem pozwalającym na ocenę efektywności pracy komory serca jest rzut minutowy, czyli objętość krwi przepompowywanej przez komorę w ciągu jednej minuty. Jego wartość jest iloczynem częstości akcji serca i wartości rzutu jednostkowego (objętości krwi przepompowanej przez komorę serca w czasie jednego skurczu – różnica pomiędzy objętością komory serca na początku i pod koniec skurczu).
Modelowanie pracy układu krążenia może również służyć jako źródło informacji na temat charakteru zmian wielu funkcji hemodynamicznych. Mogą to być zarówno wielkości ciśnień, np.: ciśnienie w komorze serca, ciśnienie przedsionkowe, ciśnienie aortalne (rys. 10a), przebiegi natężeń przepływu krwi, np. zasilającej i opuszczającej komorę serca (rys. 10b), jak i inne.
Zmiana parametrów bloków funkcyjnych, takich jak oporność zastawek, oporność tętnicza krążenia systemowego lub objętość spoczynkowa komory, umożliwia symulację różnych patologii układu krążenia. Przykładowo, niewydolność lewej komory serca może być modelowana przez zmianę parametrów bloku LH: zwiększenie wartości objętości spoczynkowej komory i zmniejszenie wartości maksymalnej funkcji elastancji. Kolejne badania dotyczyły pracy układu przy zastosowaniu wspomagania. W tym celu przeprowadzono symulację numeryczną dla stanu niewydolności lewej komory bez i z dołączonym wspomaganiem równoległym. Kompletny model układu krążenia wraz z dołączonym urządzeniem LVAD pokazano na rys. 11.
Głównym celem stosowania wspomagania układu krążenia jest zwiększenie rzutu minutowego, zmniejszenie ciśnienia przedsionkowego i zwiększenie ciśnienia w układzie tętniczym. Dołączenie urządzenia LVAD powoduje również obniżenie wartości rzutu jednostkowego naturalnej komory serca. W wyniku tego pole pętli pracy serca na płaszczyźnie ciśnienie-objętość ulega zmniejszeniu, co odpowiada redukcji pracy wykonywanej w czasie skurczu mięśnia serca. Oznacza to odciążenie chorego narządu i umożliwienie jego regeneracji.
Wyniki otrzymane w trakcie modelowania są zgodne z przewidywaniami. Wartość ciśnienia w układzie żylnym krążenia płucnego i ciśnienia przedsionkowego zmalała (rys. 12), co wiąże się z przepompowaniem krwi przez urządzenie wspomagające. Bez jego pomocy, przy niewydolności komory, krew zbiera się w układzie żylnym powodując znaczny wzrost ciśnienia. Zmniejszeniu uległ także rzut jednostkowy lewej komory (rys. 13), jednak pojawienie się dodatkowego rzutu wypracowanego przez urządzenie wspomagające powoduje oczekiwany wzrost ciśnienia w układzie tętniczym krążenia systemowego (rys. 14).
Podsumowanie
Artykuł prezentuje podstawowe cechy i zalety biblioteki Human Circulatory System wykonanej w pakiecie programowym PExSim i przeznaczonej do modelowania numerycznego układu krążenia człowieka. Krótki opis poszczególnych bloków ukazuje ich funkcjonalność i elastyczność, umożliwiającą symulację konkretnych stanów fizjologicznych, zarówno prawidłowych jak i patologicznych. Dodanie prostego modelu urządzenia wspomagającego VAD pozwala na badanie wpływu jego działania na warunki hemodynamiczne panujące w układzie. Może on być dołączany do modelu układu krążenia zarówno jako element bocznikujący względem lewej, prawej jak i obu komór serca równocześnie.
Opracowana platforma może służyć do przeprowadzania różnorodnych badań naukowych ale także jako użyteczne narzędzie w procesach nauczania, pozwalające na uatrakcyjnienie zajęć i lepsze zrozumienie procesów zachodzących w układzie krążenia człowieka.
Bibliografia
- Boschetti F., Mantero S., Miglietta F., Costantino M., Montevecchi F., Fumero R.: An approach to computer automation of the extracorporeal circulation. Computers in Biology and Medicine, vol. 32, 2002, 73–83.
- Liand C., H. Cheng H.: A nonlinear fluid model for pulmonary blood circulation. Journal of Biomechanics, vol. 26, 1992, 91–107.
- Tsuruta H., Sato T., Shirataka M., N.Ikeda N.: Mathematical model of cardiovascular mechanics for diagnostic analysis and treatment of heart failure. Part 1. Model description and theoretical analysis. Medical & Biological Engineering & Computing, vol. 32, 1994, 3–11.
- De Lazzari C., Darowski M., Ferrari G., Clemente F., Guaragno M.: Computer simulation of haemodynamic parameters changes with left ventricle assist device and mechanical ventilation. Computers in Biology and Medicine, vol. 30, March 2000, 55–69.
- Costanzo L.S.: Physiology, 4th ed., ser. Board review series. Lippincott Williams & Wilkins, 2007.
- Ferrari G.: Study of artero-ventricular interaction as an approach to the analysis of circulatory physiopathology: Methods, tools and applications. Ph.D. dissertation, Consiglio Nazionale delle Ricerche, Rome, Italy.
- WORLDHEART - Technology for Life
- Thoratec - Innovative Therapies for Advanced Heart Failure
- Fundacja Rozwoju Kardiochirurgii
mgr inż. Alicja Golnik
Absolwentka i doktorantka Wydziału Mechatroniki Politechniki Warszawskiej zatrudniona na stanowisku asystenta w Instytucie Automatyki i Robotyki. Zainteresowania naukowe autorki obejmują zagadnienia związane z modelowaniem i sterowaniem procesów, ze szczególnym uwzględnieniem modelowania i symulacji pracy układu krążenia człowieka oraz urządzenia wspomagającego pracę serca.
mgr inż. Bartłomiej Fajdek
Ukończył studia na kierunku Automatyka i Robotyka na Wydziale Mechatroniki Politechniki Warszawskiej. Zainteresowania naukowe autora obejmują szereg zagadnień z dziedziny robotyki, ze szczególnym uwzględnieniem modelowania oraz symulowania manipulatorów.
prof. dr hab. inż. Krzysztof Janiszowski
Działalność naukowa w zakresie identyfikacji, modelowania i sterowania procesów. Obszary badań aplikacyjnych: identyfikacja procesów przemysłowych, synteza algorytmów sterowania dla pneumatycznych układów pozycjonujących, hydraulicznych napędów wyporowych, zespołu napędu hybrydowego o 2 stopniach swobody oraz pakiety oprogramowania do identyfikacji układów dynamicznych (IDCAD) i modelowania, symulacji działania i sterowania procesów przemysłowych (PExSim).




![Rys. 1. Widok biblioteki HCS w pakiecie programowym PExSim [HSC library tree view in PExSim] Rys. 1. Widok biblioteki HCS w pakiecie programowym PExSim [HSC library tree view in PExSim]](/var/aol/storage/images/artykuly/oprogramowanie/modelowanie-ukladu-krazenia-z-mozliwoscia-rownoleglego-wspomagania-pracy-komor-serca-w-pakiecie-programowym-pexsim/61014-2-pol-PL/Modelowanie-ukladu-krazenia-z-mozliwoscia-rownoleglego-wspomagania-pracy-komor-serca-w-pakiecie-programowym-PExSim_articleimage.jpg)
![Rys. 1. Widok biblioteki HCS w pakiecie programowym PExSim [HSC library tree view in PExSim] Rys. 1. Widok biblioteki HCS w pakiecie programowym PExSim [HSC library tree view in PExSim]](/var/aol/storage/images/media/par/11_10/golnik/im1_300j.jpg/77857-1-pol-PL/im1_300j.jpg_medium.jpg)
![Rys. 2. Model układu krążenia wykonany w programie PExSim [A model of human circulatory system in PExSim package] Rys. 2. Model układu krążenia wykonany w programie PExSim [A model of human circulatory system in PExSim package]](/var/aol/storage/images/media/par/11_10/golnik/im2_300.jpg/77860-1-pol-PL/im2_300.jpg_large.jpg)
![Rys. 3. Bloki funkcyjne lewej i prawej komory serca [Left and Right Ventricle blocks] Rys. 3. Bloki funkcyjne lewej i prawej komory serca [Left and Right Ventricle blocks]](/var/aol/storage/images/media/par/11_10/golnik/im3_300-maly.jpg/77863-1-pol-PL/im3_300-maly.jpg_medium.jpg)
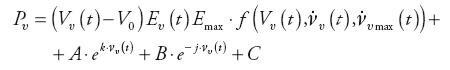
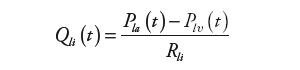
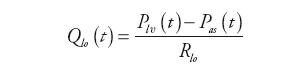
![Rys. 4. Blok funkcyjny krążenia tętniczego systemowego [Systemic Arterial Circulation block] Rys. 4. Blok funkcyjny krążenia tętniczego systemowego [Systemic Arterial Circulation block]](/var/aol/storage/images/media/par/11_10/golnik/im4_300j.jpg/77875-1-pol-PL/im4_300j.jpg_medium.jpg)
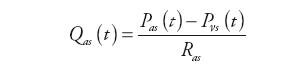
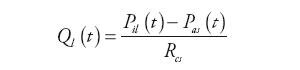
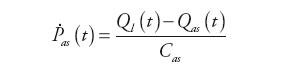
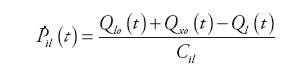
![Rys. 5. Blok funkcyjny krążenia tętniczego płucnego [Pulmonary Arterial Circulation block] Rys. 5. Blok funkcyjny krążenia tętniczego płucnego [Pulmonary Arterial Circulation block]](/var/aol/storage/images/media/par/11_10/golnik/im5_300j.jpg/77890-1-pol-PL/im5_300j.jpg_medium.jpg)
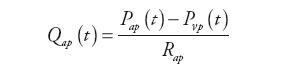
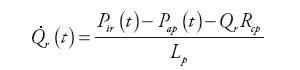
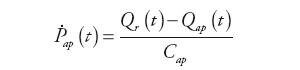
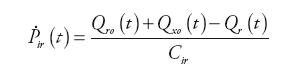
![Rys. 6. Blok funkcyjny krążenia żylnego systemowego [Systemic Venous Circulation block] Rys. 6. Blok funkcyjny krążenia żylnego systemowego [Systemic Venous Circulation block]](/var/aol/storage/images/media/par/11_10/golnik/im6_300.jpg/77905-1-pol-PL/im6_300.jpg_medium.jpg)
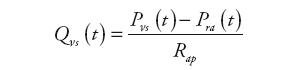
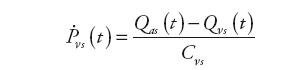
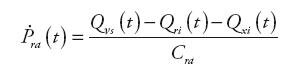
![Rys. 7. Blok funkcyjny krążenia żylnego płucnego [Pulmonary Venous Circulation block] Rys. 7. Blok funkcyjny krążenia żylnego płucnego [Pulmonary Venous Circulation block]](/var/aol/storage/images/media/par/11_10/golnik/im7_300j.jpg/77917-1-pol-PL/im7_300j.jpg_medium.jpg)
![Rys. 8. Blok funkcyjny urządzenia wspomagającego pracę komory serca [Ventricular Assist Device block] Rys. 8. Blok funkcyjny urządzenia wspomagającego pracę komory serca [Ventricular Assist Device block]](/var/aol/storage/images/media/par/11_10/golnik/im8_300j.jpg/77920-1-pol-PL/im8_300j.jpg_medium.jpg)
![Rys. 9. Pętla pracy serca na płaszczyźnie ciśnienie-objętość na przykładzie lewej komory serca (a – napełnianie, b – skurcz izowolumertyczny c – wyrzut, d – rozkurcz izowolumertyczny) [Left ventricle pressure-volume plane ( a – filling, b – isovolumetric contraction, c – ejection, d – isovolumetric relaxation)] Rys. 9. Pętla pracy serca na płaszczyźnie ciśnienie-objętość na przykładzie lewej komory serca (a – napełnianie, b – skurcz izowolumertyczny c – wyrzut, d – rozkurcz izowolumertyczny) [Left ventricle pressure-volume plane ( a – filling, b – isovolumetric contraction, c – ejection, d – isovolumetric relaxation)]](/var/aol/storage/images/media/par/11_10/golnik/im9_300.jpg/77923-1-pol-PL/im9_300.jpg_medium.jpg)
![Rys. 10. Wynik symulacji zmian: a) ciśnienia w komorze serca (Plv), ciśnienia w układzie tętniczym systemowym (Pas) i ciśnienia aortalnego (Pil), b) natężenia przepływu krwi zasilającej (Qli) i opuszczającej komorę serca (Qlo) [Simulation of a) ventricular pressure (Plv), systemic arterial pressure (Pas) and aortic pressure (Pil), b) input (Qli) and output (Qlo) flows of left ventricle] Rys. 10. Wynik symulacji zmian: a) ciśnienia w komorze serca (Plv), ciśnienia w układzie tętniczym systemowym (Pas) i ciśnienia aortalnego (Pil), b) natężenia przepływu krwi zasilającej (Qli) i opuszczającej komorę serca (Qlo) [Simulation of a) ventricular pressure (Plv), systemic arterial pressure (Pas) and aortic pressure (Pil), b) input (Qli) and output (Qlo) flows of left ventricle]](/var/aol/storage/images/media/par/11_10/golnik/im10_300j.jpg/77926-1-pol-PL/im10_300j.jpg_large.jpg)
![Rys. 11. Model układu krążenia z dołączonym urządzeniem wspomagającym LVAD [Model of circulatory system with LVAD] Rys. 11. Model układu krążenia z dołączonym urządzeniem wspomagającym LVAD [Model of circulatory system with LVAD]](/var/aol/storage/images/media/par/11_10/golnik/im11_300.jpg/77929-1-pol-PL/im11_300.jpg_large.jpg)
![Rys. 12. Wynik symulacji ciśnienia w układzie żylnym płucnym (Pvp) i ciśnienia przedsionkowego (Pla) dla warunków fizjologicznych prawidłowych, patologii oraz patologii ze wspomaganiem LVAD [Venous pulmonary pressure (Pvp) and left atrium pressure (Pla) for healthy heart, pathology condition and pathology condition with parallel assistance (LVAD)] Rys. 12. Wynik symulacji ciśnienia w układzie żylnym płucnym (Pvp) i ciśnienia przedsionkowego (Pla) dla warunków fizjologicznych prawidłowych, patologii oraz patologii ze wspomaganiem LVAD [Venous pulmonary pressure (Pvp) and left atrium pressure (Pla) for healthy heart, pathology condition and pathology condition with parallel assistance (LVAD)]](/var/aol/storage/images/media/par/11_10/golnik/im12_300.jpg/77932-1-pol-PL/im12_300.jpg_medium.jpg)
![Rys. 13. Wynik symulacji pętli pracy lewej komory serca dla warunków fizjologicznych prawidłowych, patologii oraz patologii ze wspomaganiem LVAD [Left ventricle pressure-volume loop for healthy heart, pathology condition and pathology condition with parallel assistance (LVAD)] Rys. 13. Wynik symulacji pętli pracy lewej komory serca dla warunków fizjologicznych prawidłowych, patologii oraz patologii ze wspomaganiem LVAD [Left ventricle pressure-volume loop for healthy heart, pathology condition and pathology condition with parallel assistance (LVAD)]](/var/aol/storage/images/media/par/11_10/golnik/im13_300.jpg/77935-1-pol-PL/im13_300.jpg_medium.jpg)
![Rys. 14. Wynik symulacji ciśnienia komorowego (Plv) i ciśnienia w układzie tętniczym systemowym (Pas) dla warunków fizjologicznych prawidłowych, patologii oraz patologii ze wspomaganiem LVAD [Left ventricular pressure (Plv) and systemic arterial pressure (Pas) for healthy heart, pathology condition and pathology condition with parallel assistance (LVAD)] Rys. 14. Wynik symulacji ciśnienia komorowego (Plv) i ciśnienia w układzie tętniczym systemowym (Pas) dla warunków fizjologicznych prawidłowych, patologii oraz patologii ze wspomaganiem LVAD [Left ventricular pressure (Plv) and systemic arterial pressure (Pas) for healthy heart, pathology condition and pathology condition with parallel assistance (LVAD)]](/var/aol/storage/images/media/par/11_10/golnik/im14_300.jpg/77938-1-pol-PL/im14_300.jpg_medium.jpg)